[ad_1]
東京大学
東北大学
サヴィッド・セラピューティックス株式会社
発表のポイント
- がんの薬剤耐性細胞に対してよく効くデュオカルマイシンを使用したAMDC新規薬物送達システムの製造手法を開発しました。
- このAMDCは細胞内への内在化活性の強いHER2という標的分子に結合するVHH抗体を用いて、薬剤単独よりも30倍、がん特異性が高いことが分かりました。
- ヒト乳がんを移植したマウスで、他の臓器に病理的変化が見られず、腫瘍を消失させる投与条件を発見しました。臨床試験に向けた開発の加速化が期待されます。
発表概要
東京大学アイソトープ総合センター 杉山 暁 助教、同大学大学院薬学系研究科 金井 求 教授、山次 健三 助教(現:千葉大学大学院薬学研究院 教授)、巽 俊文 日本学術振興会 特別研究員PD、東北大学大学院薬学研究科 坂田 樹理 助教、徳山 英利 教授らの研究チームはVHH抗体(注1)を使用したAMDC(注2)(抗体ミメティクス(注3)結合薬)で、がん細胞へ制癌剤デュオカルマイシン(注4)を送達し細胞を殺傷する新しい手法を考案・確立しました。
これまでのAMDCは細胞表面にとどまり、細胞内への内在化(注5)活性が低かったため、結合する薬剤は光増感剤(注6)やラジオアイソトープ(注7)を使用していました。今回は、内在化活性の強いVHH抗体を用いて、制癌活性の強いデュオカルマイシン結合薬での治療効果を証明できました。特に、ヒト乳がんを移植したマウスで、他の臓器に病理的変化が見られず、腫瘍を消失させる投与条件を発見しました。
研究チームは、HER2分子を認識するVHH抗体と強い制癌活性を持つデュオカルマイシンを用いた AMDC の分子デザインを考案し、合成に成功しました。この結果得られたAMDCをマウスに投与したところ、腫瘍を消失させることが可能であることを確認しました。デュオカルマイシンは強い制癌活性を持っています。そのため、単独では高い副作用があり薬としての開発は中止されました。本研究結果は、副作用を抑えつつ効果を高めることに成功しました。現リード化合物(抗HER2 VHH-CupidとPsyche-デュオカルマイシン)を人体に使用するための安全性の確認を迅速に進め、臨床試験に向けた開発の加速化が期待されます。
本研究成果は、国際雑誌「Protein Expression and Purification」(2023年10月4日)にオンライン掲載されました。
発表内容
〈研究の背景〉
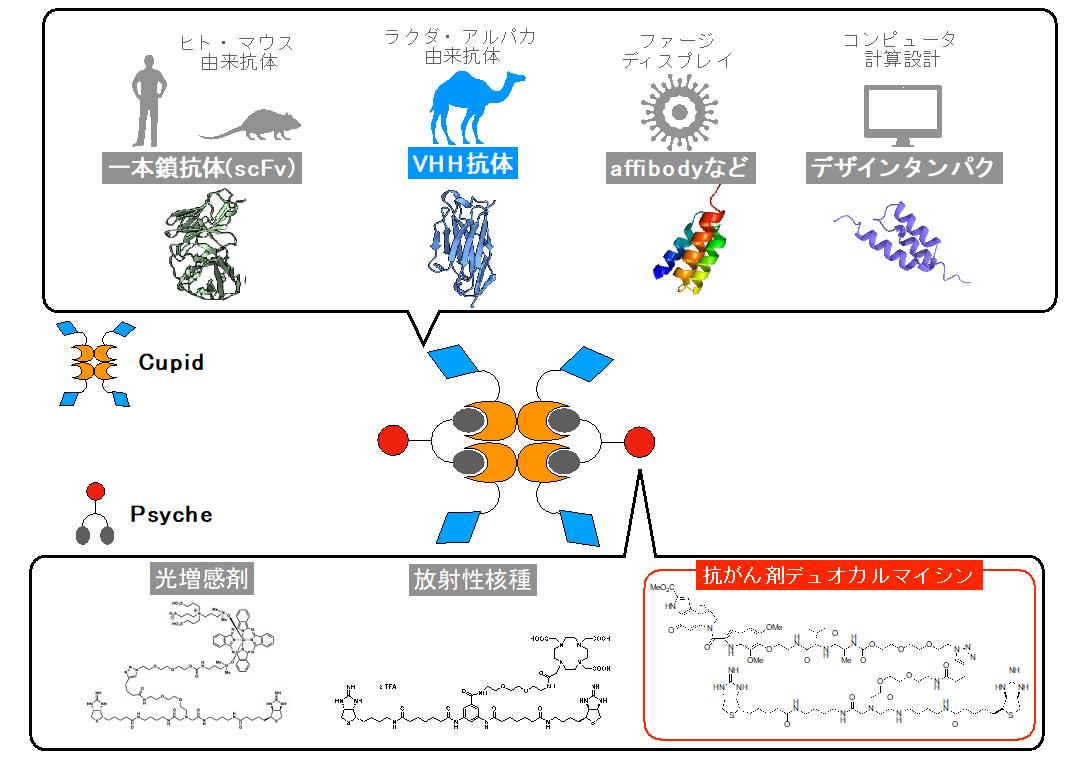
従来の抗体(免疫グロブリン;IgG)に制癌剤を共有結合した抗体薬物複合体の開発が進められています。しかし、均質性を求められる薬剤であるため、抗体に薬剤を共有結合で結合させる場合、結合部位や結合個数のコントロールが難しい製造や保存安定性の問題により生じる開発コストの課題解決が求められています。このような問題に対し本研究チームでは、より容易に薬剤の結合部位や結合個数をコントールするために、タンパク質のストレプトアビジン(注8)とビオチン(注9)が非共有結合を形成する仕組みを用いた薬物送達システム(Cupid-Psycheシステム)の開発を進めています(図1)。
-
図1:Cupid-Psycheシステムの概略
Cupid-Psycheシステムでは、Cupidに融合するがん細胞を認識するタンパク質の選択性があります。VHH抗体やアフィボディー(抗体ミメティクスの1つ)などから、転移、再発し性質が変わってしまったがん細胞を認識できるものを選択し、迅速に製造できます。また、薬剤耐性を獲得したがん細胞に対し、効果のある薬剤を選択できるようPsyche-薬剤も多種類を迅速に製造可能です。Cupid-Psycheは非共有結合で結合するため、混ぜるだけで抗体ミメティクス薬物結合薬を調製することが可能です。
Cupid-Psycheシステムは、タンパク質と低分子が生み出す結合のうち自然界で最も強いと考えられているストレプトアビジンとビオチンの結合作用を利用した薬物送達システムです。Cupidは放線菌由来のストレプトアビジンタンパク質をアミノ酸改変したものです。具体的には、人体内で異物と認識されないようにストレプトアビジンのアミノ酸配列を人工的に人のアミノ酸に似た形に変化させてあります。さらにCupidは、天然ビオチンは結合できないようにアミノ酸配列を変化させてあります。Cupidにがん細胞を認識する抗体ミメティクスを結合し1つの遺伝子として、大腸菌で融合タンパク質として製造することで、狙ったがん細胞へ結合する能力を持たせることができます。Cupidは天然ビオチンの代わりとなる人工的に設計したPsycheと非共有結合で強い結合を形成します。Psycheにはリンカー(注10)を介し薬剤を結合することができCupidと非共有結合を形成し狙ったがん細胞へ薬剤を送達することが可能です。現在までにscFv抗体やアフィボディー(抗体ミメティクスの1つ)をCupidと融合したタンパク質を大腸菌で製造する方法を確立し、ペイロード(薬剤)として光増感剤、ラジオアイソトープを使用したAMDCによるがん細胞への薬物送達技術開発を進めてきました。
今回、本研究チームは、VHH抗体とCupidを融合したタンパク質を分子デザインし、大腸菌の封入体(注11)から製造する技術を確立しました。また、単独では高い副作用のため使用できなかったデュオカルマイシンを効果的に使用するためにPsyche-デュオカルマイシンの分子デザインと合成を行いました。これらのAMDCを調製しマウスでの治療効果の検証を行いました。
〈研究の内容〉
まず、本研究では乳がんや消化器がんで発現が多い、HER2をターゲットにしたVHH抗体を使用しました。VHH抗体は細胞表面抗原に結合後、細胞内に内在化される特徴を持っています。HER2を認識する VHH抗体とCupidの融合タンパク質(以下、抗HER2 VHH-Cupid)を大腸菌の封入体として発現し、変性・巻き戻しおよび4量体タンパク質の最終精製法の至適化を行いました。一方、ペイロードであるPsyche-デュオカルマイシンは、細胞内取り込み後、細胞内のカテプシンB酵素で切断されPsycheから遊離可能なリンカーをデザインしPsycheとデュオカルマイシンを繋いだ化合物を合成しました。
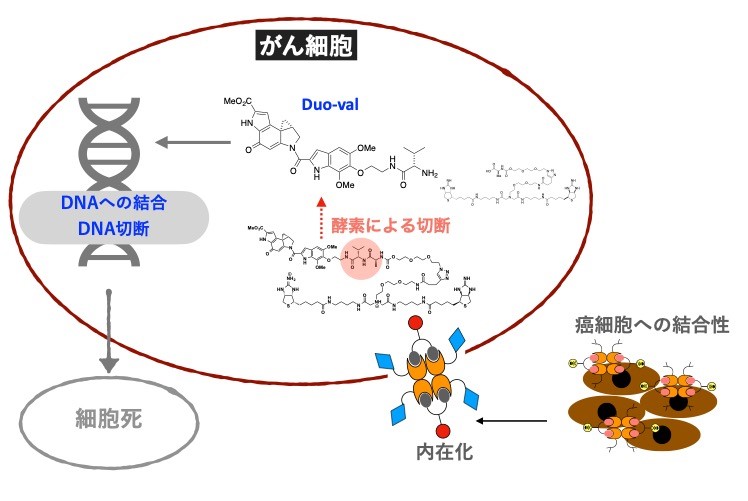
その結果、4量体タンパクとして精製された抗HER2 VHH-CupidとPsyche-デュオカルマイシンから作られたAMDCはヒト乳がん細胞に対し濃度依存的な細胞傷害性を示し、遊離したデュオカルマイシンが速やかに細胞核内へ移行し、DNAをアルキル化により切断できることが、細胞の実験で確認されました(図2)。
-
図2:デュオカルマイシンの細胞殺傷に必須な細胞内在化
本研究では、乳がん細胞表面にあるHER2分子を認識するVHH抗体(抗HER2 VHH)を使用し、がん細胞への結合の後、細胞内に内在化を促進しています。細胞内に内在化すると、細胞内のカテプシンB(酵素)によりPsycheとデュオカルマイシンを繋いでいるリンカーが切断されデュオカルマイシン(Duo-val)が遊離します。遊離したデュオカルマイシンは細胞核内のDNAと結合しDNAを切断します。DNAを切断された細胞は死んでしまいます。副作用を抑え、治療効果を高めるためにはこのような複雑な仕組みが必要です。
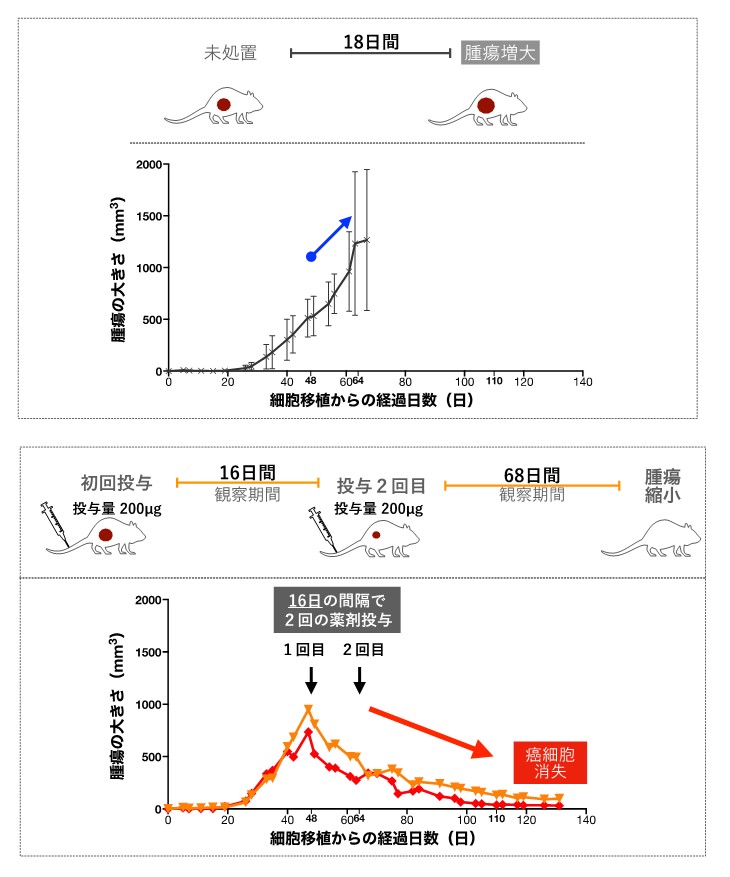
次にヒト乳がん細胞を移植したマウスでの治療効果の検証を進めたところ、16日間という短い間隔で2回投与した2匹のマウスは、緩やかな腫瘍縮小が観察されました。そして治療開始から約80日後の病理解析では、生存しているがん細胞は残っていないことが病理学的に確認されました(図3)。
本成果はAMDCが有効な治療効果をもたらすことを示すものであると言えます。
-
図3:抗体ミメティクス制癌剤結合薬のマウスでの治療効果
ヒト乳がんKPL-4細胞を移植したモデルマウスを用いた実験をした結果を示しています。上段は5匹の未処理のマウスの腫瘍の大きさの平均値の変化を示しています。エラーバーは標準偏差を示しています。細胞移植から48日目以降も腫瘍が大きくなり続けました。下段は、抗体ミメティクス制癌剤結合薬を投与した2匹のマウスの腫瘍の大きさの変化を示しています。細胞移植から48日目に1回目の薬剤投与を行い、それから16日後に2回目の投与を行いました。1回目の投与後に早い腫瘍縮小が見られたのち、2回目の投与後も緩やかな腫瘍縮小が観察されました。2回目投与68日後には癌細胞が消失していることが病理解剖により確認されました。
〈今後の展望〉
今回、細胞内在化が早いVHH抗体と制癌活性の高い制癌剤を非共有結合したAMDCにより、目的のがん細胞まで薬剤を送達でき、がんの治療効果をもたらすことに成功しました。本成果は、Cupid-PsycheシステムによるAMDCを開発していく上での足掛かりとなり、副作用を抑え治療効果の高い癌治療薬の開発を促進することが期待されます。
参考文献
1)東京大学先端科学技術研究センタープレスリリース「再発した乳がんを完全消失させる実験に成功」(2022年9月20日)
https://www.rcast.u-tokyo.ac.jp/ja/news/release/20220920.html
2)東京大学先端科学技術研究センタープレスリリース 「身体への負担の少ない抗がん剤「局所抗体ミメティクス結合薬物」の開発に成功」(2022年1月26日)
https://www.rcast.u-tokyo.ac.jp/ja/news/report/20211230.html
発表者
東京大学 先端科学技術研究センター
- 児玉 龍彦(がん・代謝プロジェクトリーダー(特任研究員)/東京大学名誉教授)
東京大学 アイソトープ総合センター
東京大学 大学院薬学系研究科
- 金井 求(教授)
- 巽 俊文(日本学術振興会 特別研究員PD)
東北大学 大学院薬学研究科
- 徳山 英利(教授)
- 坂田 樹理(助教)
千葉大学 大学院薬学研究院
- 山次 健三(教授)〈研究当時:東京大学 大学院薬学系研究科 助教〉
サヴィッド・セラピューティックス株式会社
- 塚越 雅信(代表取締役社長)
論文情報
- 雑誌:
- Protein Expression and Purification(10月4日)
- 題名:
- Antibody-mimetic drug conjugate with efficient internalization activity using anti-Her2 VHH and duocarmycin
- 著者:
- Juri Sakata, Toshifumi Tatsumi, Akira Sugiyama*, Akihiro Shimizu, Yuya Inagaki, Hiroto Katoh, Takefumi Yamashita, Kazuki Takahashi, Sho Aki, Yudai Kaneko, Takeshi Kawamura, Mai Miura, Masazumi Ishii, Tsuyoshi Osawa, Toshiya Tanaka, Shumpei Ishikawa, Masanobu Tsukagoshi, Michael Chansler, Tatsuhiko Kodama, Motomu Kanai, Hidetoshi Tokuyama*, Kenzo Yamatsugu*
*責任著者 - DOI:
- 10.1016/j.pep.2023.106375
研究助成
本研究は、文部科学省科学研究費・基盤研究B「進行がんの次世代 Antibody Drug Conjugate 治療薬の創成」(JP21H02779)および 東大発ベンチャーであるサヴィッド・セラピューティックス株式会社の支援を受けて実施されました。
用語解説
問合せ先
東京大学アイソトープ総合センター RI教育研究推進部門
助教 杉山 暁(すぎやま あきら)
[ad_2]
Source link
